Adenovirus R-gene®
Kit de PCR em tempo real para a deteção e quantificação de adenovírus ADN
- Quantificação fiável da carga viral de adenovírus ao longo de uma ampla faixa linear
- Deteção de todos os serotipos conhecidos
- Kit pronto a utilizar que inclui controlo interno e normas de quantificação
- CE-IVD para diferentes tipos de amostras e para todas as plataformas de extração principais e sistemas de PCR em tempo real
Precisa de mais informação?
Vantagens do Adenovirus R-gene®
O adenovírus é uma complicação grave em doentes imunocomprometidos, que dá origem a elevados níveis de morbilidade e mortalidade. Por esse motivo, a deteção e monitorização otimizadas da infeção por adenovírus é muito importante para melhorar o tratamento dos doentes. Adenovirus R-gene® é uma solução ideal uma vez que proporciona deteção e/ou quantificação do genoma de todos os serotipos de adenovírus conhecidos. Proporciona uma deteção rápida e específica para o ajudar a controlar a evolução da infeção e a monitorizar a resposta ao tratamento. Para melhorar ainda mais a abrangência dos testes, a maior parte da gama R-gene® permite-lhe quantificar vários agentes patogénicos com uma só amostra ou analisar várias amostras de um vírus ao mesmo tempo.
- Sensível e reprodutível
- Medição fiável da infeção por adenovírus
- Ampla faixa linear
- Padronizado
- Perfis de teste harmonizados que permitem a realização de múltiplos testes de uma só vez
- Processamento uniforme com a gama de produtos R-gene® (CMV R-gene®, HSV1 HSV2 VZV R-gene®, CMV HHV6,7,8 R-gene®, BK Virus R-gene®, EBV R-gene®, Parvovirus B19 R-gene®, BORDETELLA R-gene®)
- Flexível
- Validado para ser utilizado com vários tipos de amostras
- Prepare as amostras manualmente ou utilize a preparação de amostras automatizada como, por exemplo, NucliSENS® easyMAG® e técnicas de configuração de teste, tais como easySTREAM™
- Qualificado para ser utilizado nas principais plataformas de PCR em tempo real
Tudo o que precisa num só kit
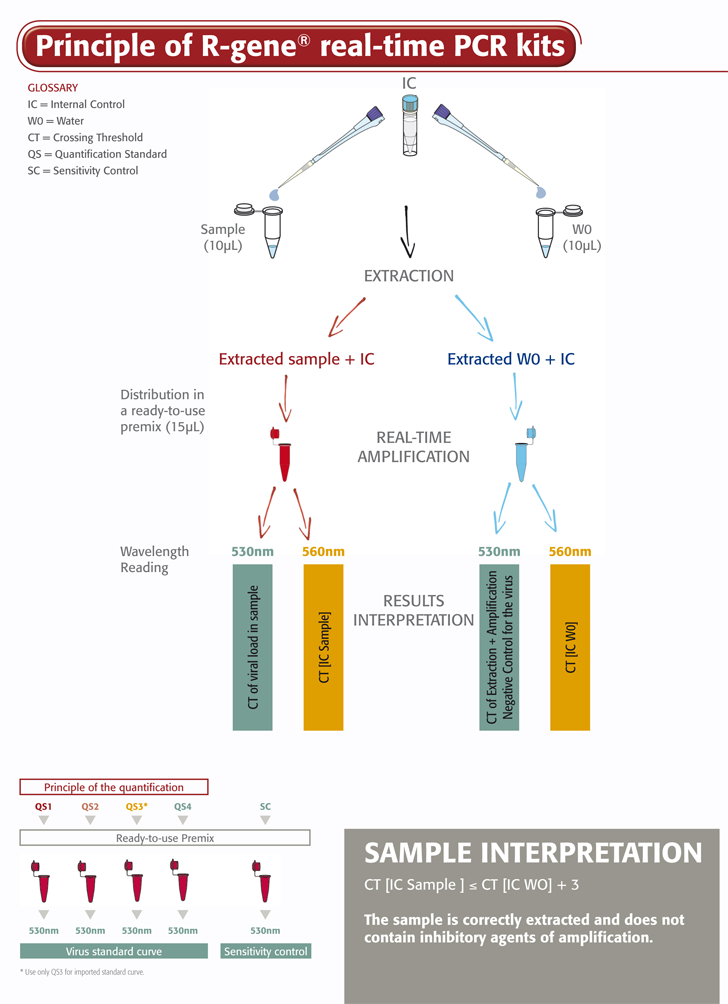
O kit Adenovirus R-gene® é um teste molecular pronto a utilizar concebido para detetar e quantificar a carga viral do adenovírus por meio de PCR em tempo real após extração de ADN. Trata-se de um teste com base na 5’ nuclease que amplia uma região específica do genoma do adenovírus.
- Quatro normas de quantificação garantem uma medição precisa da carga viral do adenovírus
- O controlo de sensibilidade valida o desempenho do teste na rotina laboratorial
- Um controlo interno (IC2) verifica o processo de extração, incluindo a lise e a presença de inibidores de amplificação na amostra
- Inclui todos os reagentes necessários otimizados para detetar e quantificar o adenovírus para uso diagnóstico in vitro
Procedimento fácil
O kit Adenovirus R-gene® é fácil de utilizar. Basta adicionar a amostra de ADN extraída à mistura principal de PCR pronta a utilizar e iniciar a reação no termociclador de PCR em tempo real apropriado, seguindo o programa de ciclos otimizados descrito na secção "Instruções de utilização".
BIOMERIEUX, o logótipo azul, ARGENE®, R-gene®, EASYMAG® e NUCLISENS® são marcas registadas e/ou pendentes de registo da bioMérieux ou de uma das suas subsidiárias ou empresas.
Qualquer outro nome ou marca pertence aos seus respetivos proprietários.
| Adenovirus R-gene® (69-010B) | |
|---|---|
| Princípio de teste | Deteção e quantificação genómica de adenovírus |
| Informação para encomendas | Referência 69-010B: O kit de deteção e quantificação Adenovirus R-gene® também está disponível com a referência 69-010: O kit COMPLETO de deteção e quantificação Adenovirus R-gene® (inclui o kit de quantificação 69-010B e o kit de extração de ADN 67-000 DNA) |
| Tecnologia | PCR em tempo real / Tecnologia Taqman de 5' nuclease |
| Alvo genético | Gene Hexon |
| Amostra* | Sangue total, plasma, LCR, fezes, biopsias, amostras oculares, amostras respiratórias (aspirado nasofaríngeo, lavagem broncoalveolar, esfregaço nasal) |
| Limite de deteção | Sangue total: 8 cópias/PCR (200 cópias/ ml) amostra nasal: 10 cópias/PCR (261 cópias/ ml) sangue total: 550 cópias/ml secreções nasais: 670 cópias/ml |
| Intervalo dinâmico de quantificação | Sangue total: 2,58 103 cópias/ml a 4,65 1010 cópias/ml amostra nasofaringe: 5,19 103 cópias/ml a 8,25 1010 cópias/ml até 5X106 cópias/ ml |
| Controlos incluídos | Extração + controlo de inibição, controlo de sensibilidade, controlo negativo |
| Resultados em | 75 minutos (fase de extração não incluída) |
| Unidade de referência | Cópias/mL |
| Número de testes | 90 testes |
| Condições de armazenamento | -18 °C/-22 °C no caso da referência 69-010B (kit de quantificação), + 2 °C / + 8 °C no caso da Ref. 67-000 (kit de extração de ADN) |
| Plataforma de extração validada* | |
| Manual | QIAamp DNA Blood Mini kit QIAamp DNA Stool Mini kit QIAcube |
| Automatizada | NucliSENS® easyMAG® QIAsymphony MagNA Pure LC MagNA Pure Compact MagNA Pure 96 Biorobot M48 m2000sp VERSANT kPCR Molecular System SP |
| Plataforma de amplificação validada* | Life Technologies (ABI7500, ABI7500 Fast & StepOne) LightCycler 1.0 LightCycler 2.0 LightCycler 480 II SmartCycler 2.0 RotorGene VERSANT kPCR Molecular System AD Biorad DX Real-Time system Stratagene / Agilent |
| Estado | Para ser utilizado para fins de diagnóstico in vitro, marca CE na Europa |
* Peça mais informações
Factos sobre o Adenovirus
O que é o adenovírus?
Os adenovírus são vírus icosaédricos de tamanho médio, de ADN de cadeia dupla, sem envelope. Foram descritas pelo menos sete espécies de adenovírus humanos (A-G), incluindo 52 serotipos. Os adenovírus podem causar doenças respiratórias, oculares ou gastrointestinais que ocorrem principalmente em crianças e recrutas militares como infeções endémicas ou durante surtos. As infeções por adenovírus são comuns e ocorrem durante todo o ano, em todo o mundo.
Quem se encontra mais em risco?
Ao longo dos últimos anos, os adenovírus têm sido cada vez mais reconhecidos como agentes patogénicos virais significativos com alta morbidade e mortalidade entre doentes imunocomprometidos. As manifestações clínicas em doentes imunocomprometidos incluem pneumonia, hepatite, cistite hemorrágica, colite, pancreatite, meningoencefalite e doença disseminada, dependendo da doença subjacente, do sistema de órgãos afetado, da idade do doente e do serotipo do vírus.
Quais são os benefícios do teste do adenovírus?
Testes com base em PCR do adenovírus em tempo real permitem a deteção rápida e específica antes da manifestação dos sintomas clínicos para ajudar a melhorar os resultados, o que é especialmente importante no caso de doentes imunosuprimidos, que podem ser gravemente afetados. O teste ajuda a fazer o seguimento da eficácia do tratamento ativo e pode ser utilizado para monitorizar a recaída depois do tratamento.
Adenovirus R-gene®: PUBLICAÇÕES
- Comparison of the EZ1 XL advanced and the Magna Pure instruments for the extraction of whole blood before DNA quantification of CMV, EBV, HHV 6 and Adenovirus
Marie Gueudin, Alexandre Louvel, Jean-Christophe Plantier, Laboratoire de virologie, CHU de Rouen, Université de Rouen, France. ECV 2013 - Comparison of in-house real-time quantitative PCR to the Adenovirus R-Gene kit for determination of adenovirus load in clinical samples.
Jeulin et al. Laboratory of Virology, Nancy University Hospital, France. J Clin Microbiol. 2010 Sep;48(9):3132-7. Epub 2010 Jul 14. - Adenoviruses in Immunocompromised Hosts
Echavarria. Laboratory of Clinical Virology, University Hospital, Buenos Aires. Clinical Microbiology Reviews, Oct 2008, 704-715 - Analytical and Clinical Evaluation of the Argene Adenovirus R-Gene Assay.
Malgorzata Kowerska et al. Department of Pathology and Laboratory Medicine, North Shore-LIJ Health System Laboratories, NY. CVS 2011 - Prognostic value of qPCR for Adenovirus detection in stool samples compared with antigen detection and cell culture in hematopoietic cell transplant recipients and evaluation of Adenovirus R-gene™ kit
Jeulin et al. Laboratory of Virology, Nancy University Hospital, France. CVS 2010 - Outbreak of Adenovirus keratoconjuntivitis in health care workers : coinfection with different Adenovirus species.
Echavarria et al. Laboratory of Clinical Virology, University Hospital, Buenos Aires. CVS 2009 - Development of a new diagnostic tool for the quantification of Adenoviruses by Real Time PCR.
Magro et al. ARGENE. ESCV 2010 - A commercial Real Time PCR for Adenovirus
Echavarria et al. Laboratory of Clinical Virology, University Hospital, Buenos Aires. ESCV 2009 - Validation of commercial (ARGENE) FLU A/B, RSV A/B and Adenovirus PCR assay.
Hocker et al. Scott&White Hospital/Texas A&M Health Science Center College of Medicine, Temple, Texas, USA. CVS 2009 - Detection of Adenovirus DNA from Clinical specimens using commercial Real Time PCR reagents.
Zheng et al. Children's Memorial Hospital, Northwestern University, Chicago, Illinois. - Real-time PCR for the detection of respiratory viruses.
Seffar et al. Molecular Diagnostic Center, Laboratory of Virology, Erasme Hospital, Brussel, Belgium. ESCV 2009 - H.JEULIN, A.SALMON, P.BORDIGONI and V.VENARD
Comparaison of In-house Real-Time Quantitative PCR to the Adenovirus R-Gene Kit for Determination of Adenovirus Load in Clinical Samples
Journal of Clinical Microbiology, Sept.2010.p.3132-3137 - TATE JE, BUNNING ML, LOTT L, LU X, SU J, METZGAR D., BROSCH L., PANOZZO CA, MARCONI VC, FAIX DJ, PRILL M, JOHNSON B, ERDMAN DD, FONSECA V, ANDERSON LJ, WIDDOWSON MA
Outbreak of Severe Respiratory Disease Associated with Emergent Human Adenovirus Serotype 14 at a US Air Force training Facility in 2007.
J Infect Dis. 15;199(10):1419-1426, May 2009 - ECHAVARRIA M.
Adenoviruses in immuno compromised Host. Clinical Microbiology reviews, Oct 2008, p.704-715. - VABRET A., GOUARIN S., JOANNES M., BARRANGER C., PETITJEAN J., CORBET S., BROUARD J., DUHAMEL JF., GUILLOIS B. AND FREYMUTH F.
Development of a PCR and hybridization-based assay (PCR ADENOVIRUS CONSENSUS) for the detection and the species identification of adenoviruses in repiratory specimens.
J.Clin virology 31(2):116-22, Oct 2004. - HEIM A., EBNET C., HARSTE G., PRING-AKERBLON P.
Rapid and Quantitative Detection of Human Adenovirus DNA by Real-Time PCR.
Journal of Medical Virology 70: 228-239, 2003.